На прием обратилась молодая пациентка. Представляю вам выписку приема врача, который выявил данное токсическое действие железа.

Суммарное количество введенного железа составило 5800 мг.
Вот выписка из предыдущей клиники, чтобы не быть голословной.


Именно выше представленная терапия и привела к появлению тяжелых токсических эффектов.
Представляю вам структурированный и академически оформленный обзор на тему: «Опасность передозировки внутривенного железа».
1. Введение
Внутривенное введение железа применяется для лечения железодефицитной анемии, когда пероральная терапия неэффективна или противопоказана. Однако превышение дозы или частое введение препаратов железа сопряжено с серьезными рисками. В отличие от пероральной формы, внутривенное железо минует физиологические барьеры и при передозировке может вызывать острую и хроническую токсичность.
2. Физиология железа и механизм регуляции
Организм строго регулирует уровень железа, главным образом за счет контроля всасывания в кишечнике и депонирования. Гепсидин — ключевой гормон, регулирующий транспорт железа через ферропортин. Внутривенное введение железа минует гепсидин-зависимые пути, увеличивая риск перегрузки тканей железом, особенно у пациентов с нарушениями метаболизма железа (напр. хронические воспаления, почечная недостаточность, β-талассемия).
3. Патофизиология перегрузки железом
- Свободное железо (NTBI – non-transferrin bound iron) после перенасыщения трансферрина становится токсичным.
- Образует свободные радикалы через реакцию Фентона:
- Fe²⁺ + H₂O₂ → Fe³⁺ + OH⁻ + ·OH
- → ➤ повреждение липидов, ДНК, белков → апоптоз, воспаление, фиброз.
- Аккумулируется в печени, сердце, поджелудочной железе, гипофизе, провоцируя органную дисфункцию.
4. Клиническая картина передозировки
4.1. Острая передозировка (редко при контролируемом введении)
- Тошнота, рвота, гипотензия, головокружение
- Лихорадка, миалгии, боли в груди
- Анафилактоидные реакции
- Гипофосфатемия
- Потенциальная полиорганная недостаточность при массивной передозировке
4.2. Хроническая передозировка (при длительном/избыточном применении)
- Гепатотоксичность: повышение АЛТ/АСТ, фиброз, риск гепатоцеллюлярной карциномы
- Кардиомиопатия: аритмии, ХСН
- Панкреатопатия: риск развития сахарного диабета 2 типа
- Иммунодепрессия: подавление нейтрофильной функции, рост инфекционных осложнений
5. Группы риска
- Пациенты на гемодиализе
- Онкогематологические пациенты
- Хроническая болезнь печени
- Наследственные гемохроматозы и талассемии
- Длительный приём внутривенного железа без контроля ферритина и трансферрина (наш клинический случай)
6. Диагностика перегрузки железом
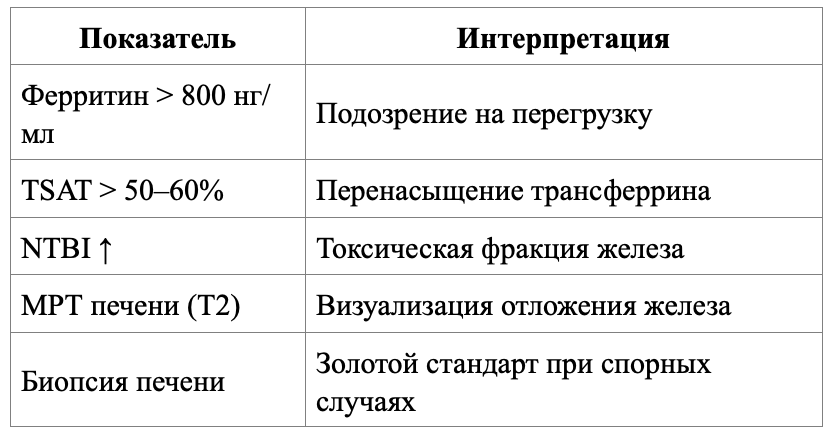
7. Профилактика и мониторинг
- Дозирование строго по индивидуально рассчитанной дозе и по показаниям: контроль ферритина и насыщения трансферрина до и после введения
- Целевые значения:
- • ферритин — 100–300 нг/мл (не выше 500)
- • TSAT — 20–40%
- Избегать повторного введения, если ферритин > 500 нг/мл
- Контроль электролитов (особенно фосфора!) после инфузии
- Мониторинг через 1–2 недели после курса терапии
8. Тактика при передозировке

ВНИМАНИЕ! Пациентке вводили феринжект (железа карбоксимальтозат) и введение хелаторов не эффективно, они не способны нейтрализовать железа карбоксимальтозат.
9. Заключение
Хотя внутривенное железо представляет собой эффективное средство лечения железодефицитной анемии, его бесконтрольное или чрезмерное использование может привести к опасной перегрузке железом. Это требует строгого мониторинга лабораторных показателей, индивидуального подбора дозировки и учета риска перегрузки у предрасположенных пациентов. Современные протоколы предполагают применение хелаторов и МРТ-навигации для оценки и коррекции состояния перегрузки, но в случае с железа карбоксимальтозатом хелаторы не работают.
Спрашивайте у ваших пациентов какие лекарства он принимает и какие схемы лечения были выполнены до приема к вам. Это в ряде случаев поможет понять с чем связаны симптомы пациента.
С уважением, ваш профессор Каневская.
